
Ranivisio® : Tout savoir sur le biosimilaire du ranibizumab de Teva Santé
Les informations essentielles :
Molécule : ranibizumab
Médicament de référence : LUCENTIS®
Faisant partie d’un groupe biosimilaire substituable en pharmacie : Oui
Posologie :
 |
|
Ranivisio® doit être administré par un ophtalmologiste qualifié ayant l’expérience des injections intravitréennes1.
|
Que contient la boîte de Ranivisio® ?
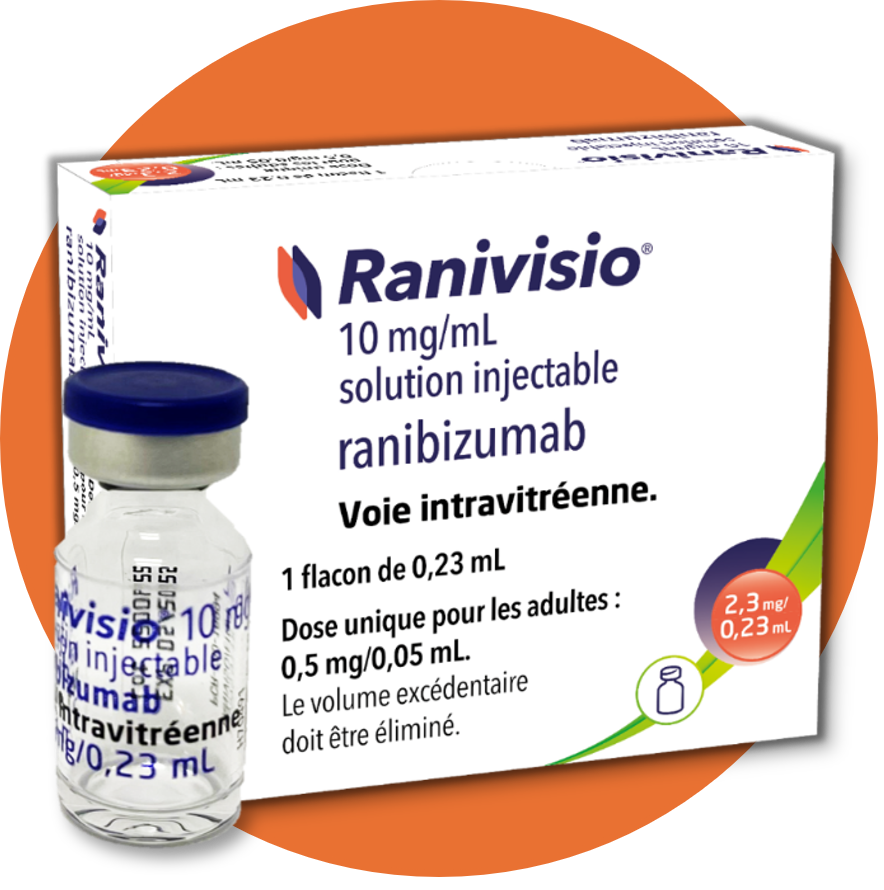
|
1 flacon de Ranivisio®1 Chaque flacon de Ranivisio® :
CIP : 34009 302 586 7 5 |
Kit d’injection associé à la délivrance de Ranivisio® en pharmacie1
|
Ce kit est livré par votre grossiste suite à chaque commande de Ranivisio®. Ce kit est réservé exclusivement à l’utilisation de Ranivisio® et doit être délivré au patient avec chaque boîte de Ranivisio® et ne peut pas être vendu. Ce kit contient :
Le kit d'injection de Ranivisio® doit être apporté par le patient lors du rendez-vous avec l'ophtalmologiste. Il est donc important de lui rappeler pour éviter tout oubli. |
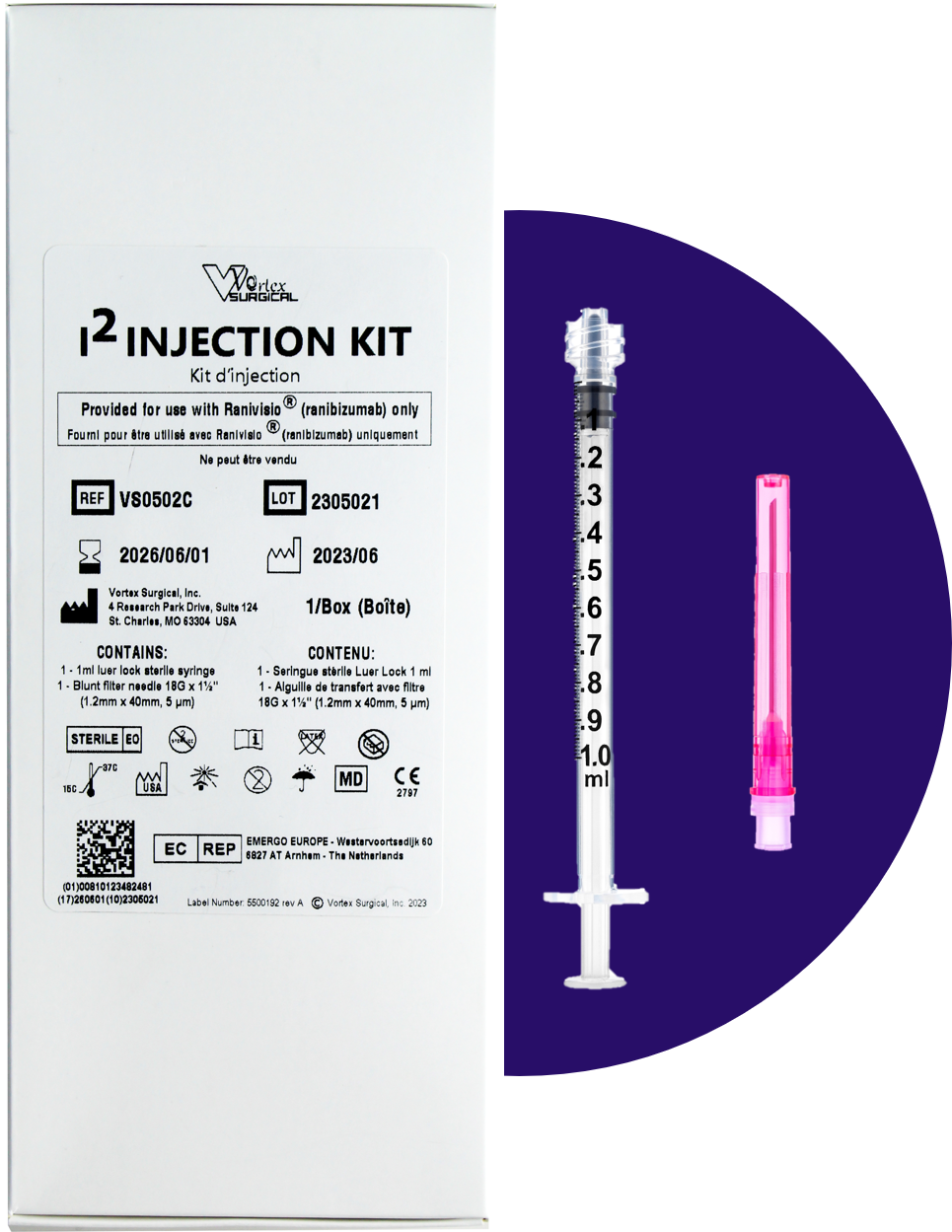 |
|
Kit d’injection I² de Ranivisio® Classe IIa Suite 124 Saint Charles, MO 63304 USA |
Conditions de conservation1
Pour bien conserver Ranivisio® :
| À conserver au réfrigérateur (entre 2°C et 8°C). | Avant l’utilisation, le flacon non ouvert pourra être conservé à t empérature ambiante (25°C) pendant une durée maximale de 24 heures. | ||
| Ne pas congeler. | Durée de conservation : 3 ans. | ||
| Conserver le flacon dans l’emballage extérieur à l’abri de la lumière. |
|
Pour bien conserver le kit d’injection I² : |
|
Le kit d'injection se conserve entre 0°C et 37°C. Le kit d'injection peut donc se conserver avec la boîte de Ranivisio® au réfrigérateur (température comprise entre 2°C et 8°C). |
Les conditions de prescription et de substitution :
Les conditions de prescription et de délivrance :
Pour être délivré en pharmacie, l’ensemble des informations suivantes concernant la prescription de Ranivisio® doivent apparaître sur l’ordonnance2 :
 |
Nom de marque (peut être le médicament de référence ou un biosimilaire du ranibizumab) et du principe actif du médicament désigné par la Dénomination Commune Internationale (DCI) Posologie et mode d’administration (à titre d’exemple) Durée de traitement |
Les conditions de substitution :
En cas de substitution, celle-ci devra s’accompagner des modalités suivantes de prescription et de dispensation3:
- Information du patient, par le prescripteur, de la possibilité de substitution par le pharmacien du médicament biologique prescrit
- Information du patient, par le pharmacien lors de la dispensation, de la substitution effective et des informations utiles pour le patient suite à cette substitution, dont le rappel des règles de conservation de la spécialité dispensée
- Mention sur l’ordonnance du nom du médicament effectivement dispensé par le pharmacien
- Information du prescripteur par le pharmacien quant au médicament dispensé
- Enregistrement par le pharmacien du nom du médicament délivré par substitution et son numéro de lot par tous moyens adaptés afin de mettre en œuvre la traçabilité requise pour tous les médicaments biologiques
- Continuité de la dispensation du même médicament lors des dispensations suivantes
Quelques données complémentaires sur Ranivisio® :

Pour commander Ranivisio® :
|
Auprès de votre grossiste |
Auprès de votre délégué pharmaceutique Teva Santé |
|
Auprès du service client Teva Santé
|
Sur la plateforme MonTeva
|
Indications et place dans la stratégie thérapeutique :
Ranivisio® est indiqué chez l’adulte :
- En première intention dans le traitement de la forme néovasculaire (humide) rétrofovéolaire de la dégénérescence maculaire liée à l’âge (DMLA) 1,6-8.
- En première intention dans le traitement de la baisse visuelle due à l’œdème maculaire diabétique (OMD), en cas de forme diffuse ou de fuites proches du centre de la macula, chez les patients adultes ayant une acuité visuelle inférieure ou égale à 5/10, et chez lesquels la prise en charge du diabète a été optimisée et après appréciation des facteurs de risques associés à l’OMD 1,6,9,10.
- En première intention dans le traitement de la baisse visuelle due à l’œdème maculaire secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR) après appréciation des facteurs de risques associés 1,6,11.
- En première intention dans le traitement de la baisse visuelle due à une néovascularisation choroïdienne (NVC) secondaire à une myopie forte (MF) 1,6,11.
- En première intention dans le traitement de la baisse visuelle due à une néovascularisation choroïdienne (NVC) secondaire à toute autre cause que la myopie forte ou que la DMLA 1,6,12.
- Dans le traitement de la rétinopathie diabétique proliférante (RDP). Ranivisio® n’a pas de place dans la stratégie thérapeutique dans le traitement de la rétinopathie diabétique proliférante (RDP) et n’est pas remboursé 1,13.
|
Ranivisio® est un médicament d’exception : Respectez les mentions de la Fiche d’Information Thérapeutique |
Conditions de prescription et de délivrance1,6-13 :
Liste I. Médicament à prescription réservée aux spécialistes en ophtalmologie.
Remboursement si prescription en conformité avec la Fiche d’Information Thérapeutique - Remboursement par la Sécurité Sociale à 100 %. Agréé aux Collectivités.
Non remboursé par la Sécurité Sociale et non agréé aux Collectivités dans l’indication « Traitement de la rétinopathie diabétique proliférante (RDP) ».
Ranivisio® doit être administré par un ophtalmologiste qualifié ayant une expérience des injections intravitréennes.
▼Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité.
Ranivisio® fait l’objet d’un Plan de Gestion des Risques. Il existe des outils de réduction des risques attachés à ce produit.
Déclarez immédiatement tout effet indésirable suspecté d’être dû à un médicament à votre Centre Régional de Pharmacovigilance (CRPV) ou sur https://signalement.social-sante.gouv.fr/
Pour une information complète, consultez le Résumé des Caractéristiques du Produit sur la base de données publique du médicament : https://base-donnees-publique.medicaments.gouv.fr
|
Références:
1. Résumé des Caractéristiques du Produit Ranivisio® en vigueur. 2. Assurance Maladie. Médicaments. Règles générales de prescription des médicaments. Mis à jour le 01 juin 2022. Disponible sur : https://www.ameli.fr/medecin/exercice-liberal/prescription-prise-charge/regles-de-prescription-etformalites/medicaments-et-dispositifs/medicaments#text_12954. [Consulté le 30/09/2024]. 3. Arrêté du 20 février 2025 fixant la liste des groupes biologiques similaires substituables par le pharmacien d’officine et les conditions de substitution et d’information du prescripteur et du patient telles que prévues au 2°de l’article L. 5125-23-2 du code de la santé publique, publié au Journal Officiel du 27 février 2025 4. Données GERS Sell Out juillet 2024. 5. Holz FG, et al. Efficacy and Safety of Biosimilar FYB201 Compared with Ranibizumab in Neovascular Age-Related Macular Degeneration. Ophthalmology. 2022 Jan;129(1):54-63. 6. HAS. Avis de la Commission de la Transparence de LUCENTIS® du 19 septembre 2018. 7. HAS. Avis de la Commission de la Transparence de LUCENTIS® du 17 juin 2015. 8. HAS. Avis de la Commission de la Transparence du 11 octobre 2017. Rapport d’évaluation sur la place dans la stratégie thérapeutique de LUCENTIS®, EYLEA® et de leurs comparateurs cliniquement pertinents dans la forme néovasculaire (humide) de la dégénérescence maculaire liée à l’âge (DMLA). 9. HAS. Avis de la Commission de la Transparence de LUCENTIS® du 2 décembre 2015. 10. HAS. Avis de la Commission de la Transparence de LUCENTIS® du 7 juillet 2021. 11. HAS. Avis de la Commission de la Transparence de LUCENTIS® du 20 mai 2015. 12. HAS. Avis de la Commission de la Transparence de LUCENTIS® du 21 février 2018. 13. HAS. Avis de la Commission de la Transparence de LUCENTIS® du 9 septembre 2020.
RANI-FR-00113 – Visa n°24/10/64389258/PM/007 – Octobre 2024

